DESCRIPCIÓN DE LA TABLA PERIÓDICA, INFORMACIÓN QUE PROPORCIONA, ¿QUE ES?, ¿PARA QUE SIRVE?, ¿COMO SE USA?
Descripción
de la tabla periódica.
1. La tabla
periódica actual es de la forma larga, fue diseñada por el químico alemán J. Werner,
en base a la Ley Periódica de Henry Moseley y la configuración
electrónica de
los átomos de los elementos.
2. Los elementos
están ordenados en el
orden creciente al número atómico de sus átomos.
3. La tabla
periódica actual está constituida
por 7 filas o periodos, a los 3 primeros periodos se denominan “cortos”,
el cuarto y quinto se denominan “largos” y los restantes “extralargos”.
4. Presentan 18
columnas que constituyen 16
grupos o familias que se ordenan en 8 grupos “A” y 8
grupos “B”.
Que
información obtengo de la tabla periódica.

En ella
puedes obtener todo tipo de información de los elementos químicos: número
atómica, masa, electronegatividad, reactividad, proporción en la naturaleza y
otros muchos más en las científicas
¿Que es?
 La tabla periódica o sistema periódico es
un esquema que
muestra la estructura y disposición de los elementos químicos, de acuerdo a una
ley periodicidad, la cual consiste en que “las
propiedades de los elementos son una función periódica de sus números atómicos”.
La tabla periódica o sistema periódico es
un esquema que
muestra la estructura y disposición de los elementos químicos, de acuerdo a una
ley periodicidad, la cual consiste en que “las
propiedades de los elementos son una función periódica de sus números atómicos”.
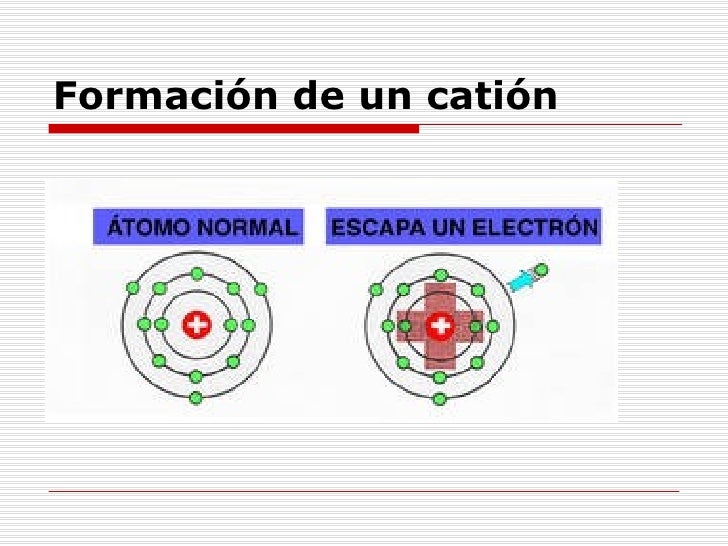
De esta manera, todos los elementos químicos se
encuentran ordenados en orden creciente de su número atómico,
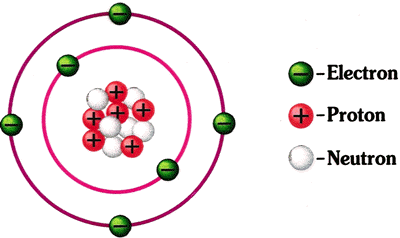
el cual representa el número de protones del núcleo de su átomo y por consiguiente, el de
electrones que se encuentran en la corona.
¿Para que sirve la Tabla periódica?
sirve
para mostrar las relaciones entre los distintos elementos; también puede ser
usada para predecir las propiedades de nuevos elementos aún descubiertos o no
sintetizados aun.
¿Como se usa?
1.
El número atómico en la parte superior izquierda: número de protones de un átomo del
elemento.
2. El símbolo del elemento: una o dos letras del nombre latino o latinizado
del elemento del elemento. A partir del elemento 110 se usan, provisionalmente,
tres letras.
3.
En la
parte inferior: masa atómica, energías, y otros valores periódicos. El color del
texto o del fondo ayuda visualizar las variaciones correspondientes.